烯烴的臭氧化、炔烴的氧化
臭氧廣泛的用途是進行碳碳雙鍵的氧化斷裂����,根據(jù)后處理條件的不同可生成羰基化合物或醇。這些反應(yīng)一般是在低溫(–25~–78 oC)下����,混合于空氣或者氧氣中的臭氧氣流通過底物在惰性溶劑中進行的。常用的溶劑是CH2Cl2和MeOH��,或者是二者的混合溶劑�。很多烯烴都能進行臭氧化反應(yīng),給電子基團取代的雙鍵比吸電子基團取代的雙鍵反應(yīng)更快�����。還原的后處理過程生成醛�����、酮或者醇��。用LiAlH4或NaBH4后處理可以全部還原為醇��。氧化的后處理過程把過酸的臭氧分解產(chǎn)物轉(zhuǎn)化為酮或者羧酸[1]�����。用該方法可以從環(huán)烯出發(fā)制備許多產(chǎn)物 (式1)[2]��。
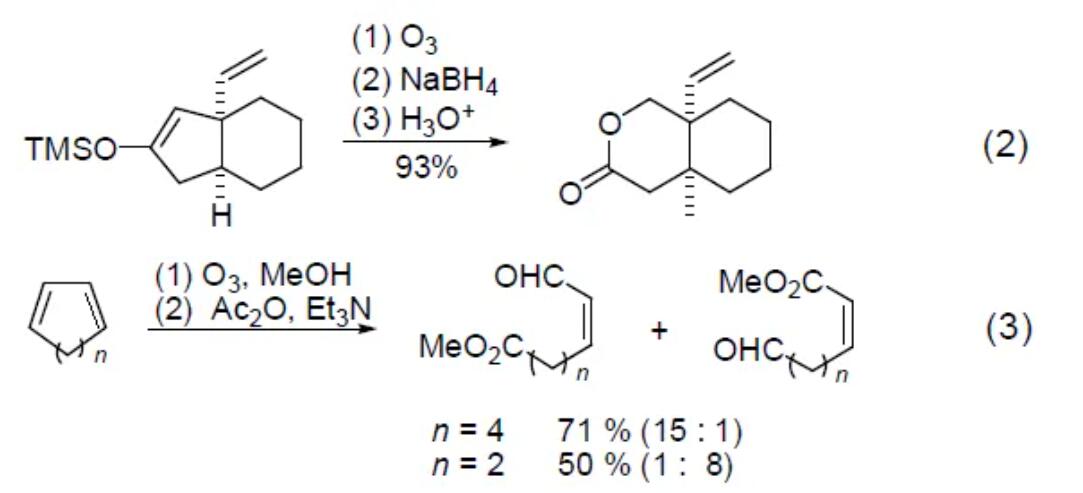
三甲基硅氧基烯由臭氧氧化斷裂,再經(jīng)過氧化后處理過程生成二酸�����,或者經(jīng)過還原后處理過程生成羥基或含氧衍生物 (式2)[3]。如果后處理條件恰當(dāng)�,這個反應(yīng)就是Baeyer-Villiger氧化的一個很好的補充。α,β-不飽和酮與臭氧的反應(yīng)一般得到比原分子少一個碳的酮酸��。1,3-二烯的臭氧分解反應(yīng)中���,雙鍵能夠發(fā)生選擇性的氧化斷裂�,在1,3-環(huán)二烯中����,一級臭氧化物碎裂的區(qū)域選擇性取決于環(huán)的大小 (式3)[4]�。位阻大的烯用臭氧化處理一般生成環(huán)氧化物。
加入 Lewis 酸可以增強臭氧的親電反應(yīng)性��。相反的���,在臭氧化反應(yīng)中加入少量吡啶�,可以明顯降低臭氧的反應(yīng)性而同時提高臭氧進攻的區(qū)域選擇性 (式7)[8]����。
相對于其它烯烴的氧化斷裂試劑而言�,臭氧是比較好的一種�����。其它試劑如四氧化鋨����、高錳酸鉀����、高碘酸鈉或羧酸鎘等都價格昂貴、有很高的毒性����,并且會造成金屬離子污染,后處理步驟復(fù)雜�。
炔烴的氧化
炔烴與臭氧的反應(yīng)比烯烴與臭氧的反應(yīng)慢[5]。當(dāng)同時有烯鍵和炔鍵存在時�����,烯鍵會優(yōu)先發(fā)生反應(yīng)�。炔烴與臭氧反應(yīng)既可以產(chǎn)生羧酸����,又可以產(chǎn)生α-二羰基化合物(還原后處理過程) (式4)[1]。很多還原試劑都可以用來生成α-二羰基化合物�。端炔在臭氧作用下能夠得到α-羰基醛。
芳香體系的臭氧分解
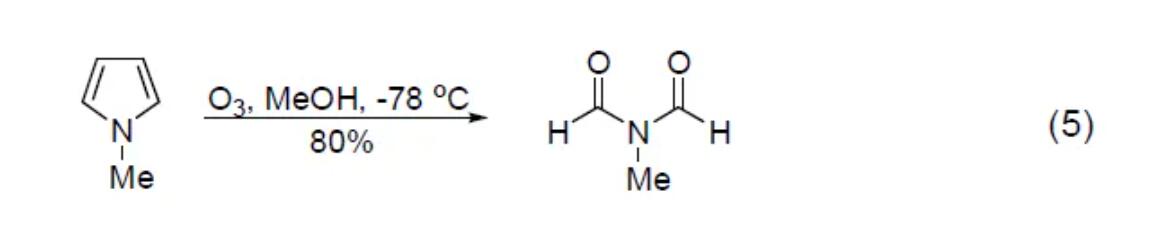
芳香化合物對臭氧的反應(yīng)性比烯烴和炔烴弱�。雜環(huán)體系的臭氧分解反應(yīng)主要包括從喹啉合成吡啶衍生物,臭氧分解咪吡咯得到N-乙酰氨基化合物 (式5)[6]��,臭氧分解呋喃體系釋放出潛在的羧酸官能團等。
雜原子的臭氧化
在臭氧作用下����,磷化氫可以轉(zhuǎn)化為氧化膦,亞磷酸鹽可以轉(zhuǎn)化為磷酸鹽�。有機硫化物在臭氧作用下可以轉(zhuǎn)化為亞砜或者砜。三級胺臭氧化可以轉(zhuǎn)化為氧化胺����,而一級胺臭氧化則以適中產(chǎn)率生成硝基化合物。硒化物在臭氧作用下轉(zhuǎn)化為硒氧化物���,此反應(yīng)經(jīng)常用于制備不飽和羰基化合物 (式6)[7]�。
其他
醛可以通過在乙酸甲酯或乙酸乙酯中臭氧化轉(zhuǎn)化為過酸�����,或者在10% 的KOH甲醇溶液中臭氧化得到甲酯����。在催化劑量的Fe3+存在下,在臭氧作用下�,NO2可以直接將苯二甲酸酯硝化 (式8)[9]。臭氧還可以氧化氮雜環(huán)丙基酯上的N-二苯甲基保護基團�,得到脫保護的氧化氮雜環(huán)丙基酯和二苯甲酮 (式9)[10]。
參考文獻
1. (a) Razumovskii, S. D.; Zaikov, G. E. Ozone and Its Reactionswith Organic Compouds, Elsevier: Amsterdam, 1984. (b)Hudlicky, M. Oxidation in Organic Chemistry, AmericanChemical Society: Washington, 1990.
2. Gupta, D.; Soman, R.; Dev, S. K. Tetrahedron, 1982, 38,3013.
3. (a) Clark, R. D.; Heathcock, C. H. Tetrahedron Lett., 1974,2027. (b) Clark, R. D.; Heathcock, C. H. J. Org. Chem., 1976,41, 1396.
4. Wang, Z.; Zvlichovsky, G. Tetrahedron Lett., 1990, 31, 5579.
5. Dieter Cremer, D.; Crehuet, R.; Anglada, J. J. Am. Chem. Soc.,2001, 123, 6127.
6. Kashima, C.; Harada, K.; Hosomi, A. Heterocycles, 1992, 33,385.
7. Grese, T. A.; Hutchinson, K. D.; Overman, L. E. J. Org.Chem., 1993, 58, 2468.
8. Haag, T.; Luu, B.; Hetru, C. J. Chem. Soc., Perkin. Trans. I,1988, 2353.
9. Nose, M.; Suzuki, H.; Suzuki, H. J. Org. Chem., 2001, 66,4356.
10. Patwardhan, A. P.; Lu, Z. J.; Pulgam, V. R.; Wulff. W. D.Org. Lett., 2005, 7, 2201.
本文轉(zhuǎn)自:《現(xiàn)代有機合成試劑——性質(zhì)���、制備和反應(yīng)》,胡躍飛等編著